当前位置:首页 → 职业资格 → 教师资格 → 中学化学学科知识与教学能力->阅读材料.根据任务完成要求材料1:《义务教育化学课程标准(2
阅读材料.根据任务完成要求
材料1:《义务教育化学课程标准(2011年版)》关于金属与金属矿物的内容标准:了解金属的物理特征,认识常见金属的主要化学性质,了解防止金属腐蚀的简单方法。
材料2:某版本教科书的知识结构体系
第八单元金属和金属材料
课题1金属材料
课题2金属的化学性质
课题3金属资源的利用和保护
材料3:某版本教科书“课题2金属的化学性质”所呈现的内容:
一、金属与氧气的反应

你肯定听说过“真金不怕火炼”的说法.金在高温下也不与氧气反应.说明金的化学性质非常稳定。
从以上事实可以看出,不同的金属活泼性不同:镁、铝较活泼,铁、铜次之,金最不活泼。
【活动与探究】
在试管里放入两小块镁,加入5 mL的稀盐酸,用燃着的木条放在试管口,观察现象,并判断反应后生成了什么气体。
参照上述实验步骤,分别在放有少量锌、铁或铜的试管中加入稀盐酸,观察现象,比较反应的剧烈程度。如果有气体生成.判断生成了什么气体。
用稀硫酸代替稀盐酸进行试验,并比较发生的现象。见表1:
表1
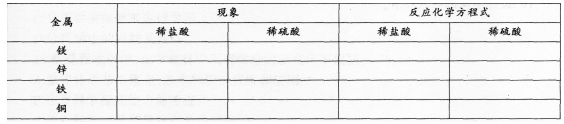
根据上述实验讨论:
1.哪些金属能与盐酸、稀硫酸发生反应?反应的剧烈程度如何?反应后生成了什么气体?哪些金属不能与盐酸、稀硫酸发生反应?根据反应时是否有气体产生,将金属分为两类。
2.对于能发生的反应,从反应物和生成物的物质类别如单质、化合物的角度分析,这些反应有什么特点?将这一类反应与化合反应、分解反应进行比较。
讨论:根据上述实验做比较。简述结论。
(二)金属与金属化合物溶液反应
【活动与探究】见表2
表2

要求:
(1)确定本课的三维教学目标。
(2)确定本课的教学重点与难点。
(3)默写金属活动顺序表,并写出元素金属性强弱的判断方法(至少三种)。
(4)设计本课的导入环节。
(1)本课的三维目标知识与技能
①知道铁、铝、铜等常见金属与氧气的反应。
②初步认识常见金属与盐酸、硫酸的反应,金属与金属盐溶液的反应,能用置换反应解释一些与日常生活有关的化学问题。
过程与方法
①通过金属和酸的反应学习控制变量法进行科学研究。
②根据金属和酸反应的剧烈程度判断金属活动性顺序。
③根据金属和金属盐溶液之间的反应判断金属活动性顺序。
情感态度与价值观
在实验操作中,获得科学方法的体验,养成实事求是的科学精神和严谨的科学态度.激发学习化学的兴趣。
(2)教学重点和教学难点
教学重点:金属和酸、金属盐溶液的反应;探究金属活动性顺序。
教学难点:金属活动性顺序探究实验的理解与分析。
(3)金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au
金属性强弱的判断方法:④根据一定条件下金属与水反应的难易程度和剧烈程度。一般情况下。与水反应越容易、越剧烈.其金属性越强。
②常温下与同浓度酸反应的难易程度和剧烈程度。一般情况下,与酸反应越容易、越剧烈,其金属性越强。
③依据金属元素最高价氧化物对应的水化物碱性的强弱。碱性越强,该金属元素的金属性越强。
④依据金属单质与金属盐溶液之间的置换反应。一般是活泼金属置换不活泼金属.但是IA族与IIA族的金属在与盐溶液反应时,通常是先与水反应生成对应的强碱和氢气,然后生成的强碱再与可溶性盐发生复分解反应。
⑤依据元素周期表。同周期元素,从左向右,随着核电荷数的增加,元素金属性逐渐减弱:同主族元素,由上而下,随着电荷数的增加.元素金属性逐渐增强。
(4)导人环节
在现代考古中,发现从地下出土的文物里,金银器皿总是比铁器保存得完整、完好,而且年代比铁器早。你知道为什么吗?这节课我们就来学习金属的化学性质,通过这节课的学习你们将会得到此问题的答案。
《义务教育数学课程标准(2011年版)》强调,课程内容要反映社会的需要、数学的特点,要符合学生的认知规律。课程内容的组织要重视过程,处理好()的关系。
设α是某一方程组的解向量,k为某一常数,则kα也为该方程组的解向量。( )

案例:
在有理数运算的课堂教学片段中,某学生的板演如下:
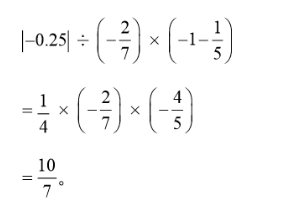
针对该学生的解答,教师进行了如下教学:
师:请仔细检查你的演算过程,看是否正确无误?
生:好像正确吧。

请分析例题1、例题2中每一步运算的依据。(10分)
初中数学课程是一门国家课程,其主要内容包括课程目标、教学内容、教学过程和( )等
教师职业道德区别于其他职业道德的显著标志就是( )。
对高中数学的评价,下列说法错误的是( )。
